【药品名称】
通用名称:硫酸阿米卡星注射液
英文名称:Amikacin Sulfate Injection
汉语拼音:Liusuan Amikaxing Zhusheye
【成 分】本品活性成份为硫酸阿米卡星。
化学名称:0-3-氨基-3-脱氧-α-D-葡吡喃糖基-(1→4)-0-[6-氨基-6-脱氧-α-D-葡吡喃糖基-(1→6)]-N3-(4-氨基-2-羟基-1-氧代丁基)-2-脱氧-L-链霉胺硫酸盐。
化学结构:
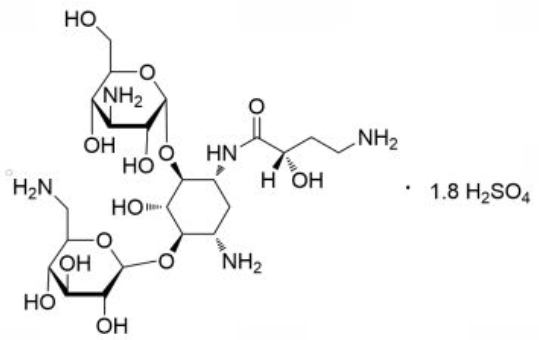
分子式:C22H43N5O13·1.8H2SO4
分子量:762.15
辅料:亚硫酸氢钠、氯化钠(供注射用)、硫酸、注射用水。
【性状
【适应症】本品适用于铜绿假单胞菌及其他假单胞菌、大肠埃希菌、变形杆菌属、克雷伯菌属、肠杆菌属、沙雷菌属、不动杆菌属等敏感革兰阴性杆菌与葡萄球菌属(甲氧西林敏感株)所致严重感染,如菌血症或败血症、细菌性心内膜炎、下呼吸道感染、骨关节感染、胆道感染、腹腔感染、复杂性尿路感染、皮肤软组织感染等。由于本品对多数氨基糖苷类钝化酶稳定,故尤其适用于治疗革兰阴性杆菌对卡那霉素、庆大霉素或妥布霉素耐药菌株所致的严重感染。
本品不用于治疗初发的单纯尿路感染,除非细菌对于其它低毒性的抗生素不敏感时才使用该类药物。
【规 格】按C22H43N5O13计(1)1ml:0.1g(10万单位) (2)2ml:0.2g(20万单位)
【用法用量】
肌肉注射或静脉滴注给药。
当静脉内给予时可以按每500mg加入100或200ml的无菌稀释剂来配制,如0.9%的生理盐水或5%的葡萄糖注射液或其它合适的溶液。缓慢静脉滴注,滴注时间一般为每次30-60分钟,婴儿滴注时间要达到1-2小时。
【不良反应】
所有氨基糖苷类药物都可能导致耳毒性、肾毒性和神经肌肉阻滞。这些毒性反应在肾损害患者、使用其他耳毒性或肾毒性药物治疗的患者以及长期和/或超量使用该类药物的患者更容易出现(详见注意事项)。
停药后肾功能的损害通常是可逆的。
对第八对脑神经的毒性作用可导致听觉丧失、平衡失调或者两者均有。阿米卡星主要影响听觉功能。耳蜗损伤包括高频性耳聋,通常发生在通过听力测试检测到的有临床意义的听力丧失之前(详见注意事项)。
据报道,玻璃体内注射阿米卡星会导致黄斑梗塞,有时导致永久性失明。
当遵循推荐的预防措施和剂量时,中毒反应的发生率较低,如耳鸣、眩晕和一些可逆性耳聋、皮疹、药物热、头痛、感觉异常、恶心和呕吐。肾脏刺激症状(蛋白尿、管型尿、尿中红细胞或白细胞增加)、氮质血症和少尿也有报道,尽管很罕见。
【禁 忌】
对阿米卡星或其他氨基糖苷类有过敏史或严重毒性反应者禁用。
【注意事项】
1.
2.神经毒性
氨基糖苷类药物的神经毒性主要表现为前庭和/或永久性双侧耳毒性,当使用了超大剂量的药物时,有肾脏病史以及肾功能正常的患者均可发生此种神经毒性,但有肾脏病史的患者发生的风险更大。高频耳聋通常首先发生,且只能通过听觉测试检查出来。如果发生眩晕,表明可能发生前庭损伤,神经毒性的其他表现可能还有麻木、皮肤针刺感、肌肉抽搐和惊厥等。氨基糖苷类药物引起的耳毒性的风险随着血药浓度的峰值和谷值的增加而增加。出现耳蜗或前庭损伤的患者在治疗期间可能没有症状来警示其发生第八对脑神经毒性,停药后可能出现完全或部分不可逆的双侧耳或致残性眩晕。氨基糖苷类药物引起的耳毒性通常是不可逆的。
3. 肾毒性
氨基糖苷类药物具有潜在的肾毒性,对肾功能异常以及使用较高剂量或治疗时间延长的患者,其产生肾毒性的风险性更大。
在可行的情况下,应监测阿米卡星的血药浓度以确保其达到足够的治疗浓度并避免其产生潜在的毒性,其血中浓度的峰值应小于35μg/ml。应对尿液比重下降、尿蛋白增加以及是否存在细胞或管型尿进行检查,也应定期检测血中尿素氮、血清肌酐或者肌酐清除率。对于年龄足够大的患者,尤其是高风险人群,应在可行的情况下建立听力量表。一旦有患者产生耳毒性的证据(眩晕、头晕、耳鸣、轰鸣、听力丧失),需立刻停药或调整剂量。
在治疗期间应给予患者足够的水分。在开始治疗前和治疗过程中,应采用常规方法评估肾功能。如果出现肾刺激的迹象(蛋白尿、管型尿、尿中白细胞或红细胞增加),应增加水分摄入。如果出现其他肾功能不全的证据(例如肌酐清除率降低、尿比重降低、血尿素氮、肌酐升高或少尿),可能需要减少剂量。如果血中尿素氮增加或尿量逐渐减少,则应停止治疗。老年患者的肾功能可能下降,在常规筛查检测(例如血尿素氮或血清肌酐)中这可能表现得并不明显。肌酐清除率测定可能更有用。需密切监测肾功能和第八对脑神经功能,尤其是在治疗开始时已知或怀疑存在肾损害的患者以及肾功能开始正常但在治疗过程中出现肾功能异常的患者。注意:当患者补水充足并且肾功能正常,如果不超过推荐剂量,则阿米卡星发生肾毒性反应的风险较低。
4. 神经肌肉毒性
据报道,在非肠道给予、局部注射(例如在矫形外科或腹部冲洗或局部治疗脓胸时)以及口服氨基糖苷类药物后会出现神经肌肉阻滞和呼吸麻痹。无论采用哪种途径给予氨基糖苷类药物,都应考虑这些症状发生的可能性,尤其是接受麻醉或神经肌肉阻滞药(如筒箭毒碱、琥珀酰胆碱、十羟季胺、阿曲库铵、罗库溴铵、维库溴铵等)或者使用大量柠檬酸盐抗凝的患者。如果阻滞发生,钙盐可以逆转这些表现,但可能需要机械呼吸辅助。
患有重症肌无力或帕金森氏症等肌肉疾病的患者慎用氨基糖苷类药物,因为这些药物可能对神经肌肉接头产生箭毒样效应,从而加剧肌无力。
5. 过敏反应
本品有发生严重过敏反应的风险,包括过敏性休克。一旦出现呼吸困难、血压下降、意识丧失等症状,应立即停药并采取适当的救治措施。氨基糖苷类药物交叉过敏已被证实,即对一种氨基糖苷类过敏的患者可能对其他氨基糖苷类也过敏。
注:若本品辅料中含有亚硫酸盐,需增加以下内容:
本品辅料中含有亚硫酸盐,可能在某些易感人群中引起过敏反应,包括过敏样症状和危及生命或较轻的哮喘发作。亚硫酸盐过敏在一般人群中的总患病率不详,很可能较低。亚硫酸盐敏感性在哮喘患者中比在非哮喘患者中更常见。
6.
7.包括阿米卡星在内的几乎所有的抗菌药物在应用中都曾有过艰难梭菌相关性腹泻(CDAD,Clostridium difficile associated diarrhea)的报道,其严重程度从轻度腹泻到致死性的结肠炎不等。抗菌药物治疗会改变患者结肠部位的正常菌群,导致艰难梭菌过度生长。
【药物相互作用】
1.应避免同时或者连续给予全身的、口服的或局部的其他肾毒性或神经毒性药物,特别是杆菌肽、顺铂、两性霉素B、头孢噻吩、头孢唑林、多粘菌素或者其它氨
基糖苷类药物。其它导致其毒性风险性增加的因素还包括高龄和脱水。
2.不能同时给予阿米卡星和强效利尿剂(依他尼酸或呋塞米),因为利尿剂本身可以导致耳毒性。此外,当静脉给药时,利尿剂通过改变血液和组织中氨基糖苷类药物的浓度来增加其毒性作用。
3.据报道,氨基糖苷类抗生素和头孢菌素肠外联合给药后,可能导致血清肌酐测定值假性升高。
4.当由不同给药途径给予氨基糖苷类药物或青霉素类药物会导致半衰期降低和血药浓度降低。只有在严重肾功能损害的患者中,氨基糖苷类药物的失活才具有临床意义。采集供分析的体液样本可能会继续失活,导致氨基糖苷类药物测定不准确。这类样本应妥善处理(及时测定、冷冻或用β-内酰胺酶处理)。
氨基糖苷类药物与β-内酰胺类抗生素(青霉素类或头孢菌素类)体外混合可能导致相互失活。与上述抗生素联合应用时必须分瓶滴注。
5.氨基糖苷类药物与双膦酸盐合用时,发生低钙血症的风险增加。
6.当氨基糖苷类药物与铂类化合物一起使用时,肾毒性和耳毒性的风险增加。
7.
8.吲哚美辛可能升高新生儿阿米卡星的血药浓度
【药理毒理】
药理作用
阿米卡星为聚阳离子、半合成的氨基糖苷类抗生素。阿米卡星通过与细菌细胞壁带负电荷的成分结合进入细菌,破坏细菌细胞壁的整体结构。其主要的作用机制为通过作用于细菌核糖体的30S亚单位,抑制细菌蛋白质合成的过程产生抗菌作用。
毒理研究
遗传毒性:尚未进行阿米卡星的致突变性试验。
生殖毒性:以成人用药剂量4倍的阿米卡星皮下给予大鼠,对雄性和雌性大鼠的生育力未见明显影响。妊娠大鼠(妊娠第8~14天)和妊娠小鼠(妊娠第7-13天)经皮下注射给予阿米卡星25、100、400mg/kg/天,低剂量和中剂量未致胎仔内脏或骨胳畸形。高剂量下可见严重的母体毒性(肾毒性和死亡),未评估该剂量对子代的影响。在子宫内暴露于上述剂量的阿米卡星的大鼠和小鼠,其出生后发育与对照组相比未见明显差异。在动物发育毒理学研究中,未充分评估子代的耳毒性。
致癌性:尚未进行动物长期研究以评估阿米卡星的致癌性。
【贮 藏】避光,密闭,不超过30°C保存。
【包 装】中硼硅玻璃安瓿,10支/盒。
【有效期】18个月
【
【批准文号】(1)按C22H43N5O13计1ml:0.1g(10万单位) 国药准字H20244432
(2)按C22H43N5O13计2ml:0.2g(20万单位) 国药准字H20244433
【生产企业】
企业名称:山西诺成制药有限公司
生产地址:山西省怀仁市高新技术工业园区








